Modern PRP: „Klinikai PRP”
Az elmúlt 10 évben a PRP kezelési sémája nagy változásokon ment keresztül.Kísérleti és klinikai kutatások révén most jobban megértjük a vérlemezkék és más sejtfiziológiát.Ezen túlmenően számos magas színvonalú szisztematikus értékelés, metaanalízis és randomizált, kontrollált vizsgálat kimutatta a PRP biotechnológia hatékonyságát számos orvosi területen, beleértve a bőrgyógyászatot, a szívsebészetet, a plasztikai sebészetet, az ortopédiai sebészetet, a fájdalomkezelést, a gerincbetegségeket és a sportorvoslást. .
A PRP jelenlegi jellemzője az abszolút thrombocyta-koncentráció, amely a PRP kezdeti definíciójáról (beleértve az alapértéknél magasabb vérlemezke-koncentrációt) több mint 1 × 10 6/µl-re, vagyis a vérlemezkék minimális vérlemezkekoncentrációjának körülbelül ötszörösére változik. alapvonal.Fadadu et al.33 PRP rendszert és protokollt értékeltek.Az egyes rendszerek által termelt végső PRP-készítmény vérlemezkeszáma alacsonyabb, mint a teljes véré.Beszámoltak arról, hogy a PRP thrombocyta-faktora 0,52-re nőtt az egyszeres centrifugálási készlettel (Selphyl®).Ezzel szemben a kettős forgású EmCyte Genesis PurePRPII ® A készülék által termelt vérlemezke-koncentráció a legmagasabb (1,6 × 10 6 /µL).
Nyilvánvaló, hogy az in vitro és az állati módszerek nem jelentik az ideális kutatási környezetet a klinikai gyakorlatba való sikeres átalakuláshoz.Hasonlóképpen, az eszköz-összehasonlító vizsgálat sem támasztja alá a döntést, mert azt mutatják, hogy a PRP-eszközök között nagyon eltérő a vérlemezke-koncentráció.Szerencsére a proteomika alapú technológián és elemzésen keresztül jobban megérthetjük a PRP-ben lévő sejtfunkciókat, amelyek befolyásolják a kezelés eredményeit.Mielőtt konszenzusra jutna a szabványosított PRP-készítményekről és készítményekről, a PRP-nek követnie kell a klinikai PRP-készítményeket, hogy elősegítse a lényeges szövetjavító mechanizmusokat és a progresszív klinikai eredményeket.
Klinikai PRP formula
Jelenleg a hatékony klinikai PRP-t (C-PRP) autológ többsejtű komponensek komplex összetételeként jellemezték kis térfogatú plazmában, amelyet a perifériás vér egy részéből centrifugálás után nyernek.Centrifugálás után a PRP és nem thrombocyta sejt komponensei különböző sejtsűrűségek szerint (amelyek közül a legkisebb a vérlemezke sűrűség) kinyerhetők a koncentráló készülékből.
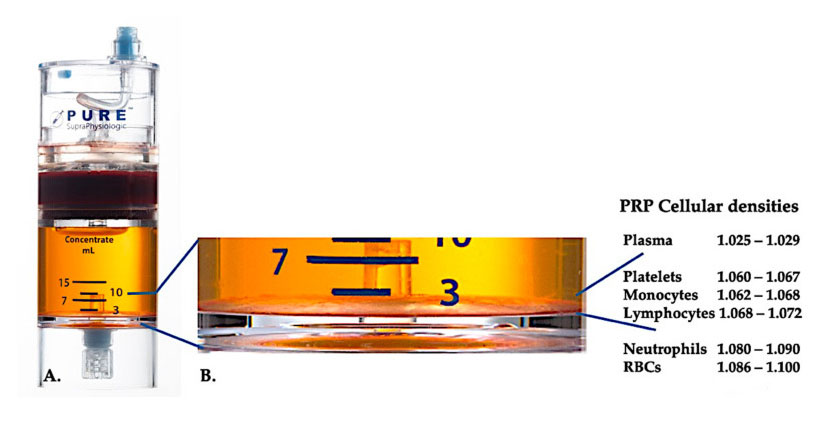
Használat PurePRP-SP® Sejtsűrűség-elválasztó berendezést (EmCyte Corporation, Fort Myers, FL, USA) használtunk a teljes vérhez két centrifugálási eljárás után.Az első centrifugálási folyamat után a teljes vér komponenst két alaprétegre, a vérlemezke (sovány) plazma szuszpenzióra és a vörösvérsejt rétegre különítettük el.Az A-ban a második centrifugálási lépés befejeződött.A tényleges PRP mennyiség kinyerhető a beteg alkalmazásához.A B-ben látható nagyítás azt mutatja, hogy a berendezés alján rendezett, többkomponensű vörösvértest-üledékes barna réteg van (kék vonallal ábrázolva), amely a sűrűséggradiens alapján nagy koncentrációban tartalmaz vérlemezkéket, monocitákat és limfocitákat.Ebben a példában a neutrofilszegény C-PRP előkészítési protokoll szerint a neutrofilek (<0,3%) és eritrociták (<0,1%) minimális százaléka lesz kivonva.
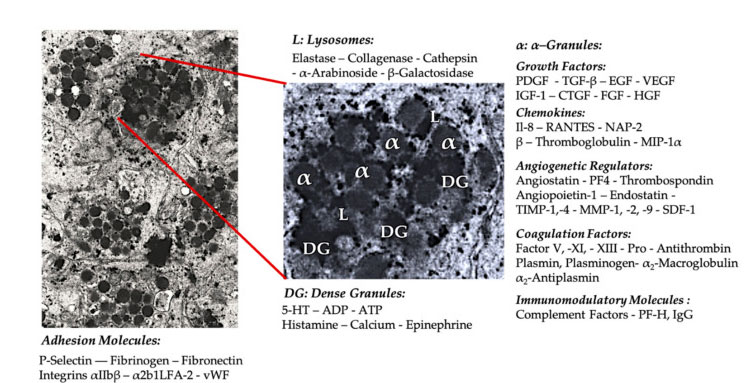
Thrombocyta granulátum
A korai klinikai PRP alkalmazásban az α-granulátumok a leggyakrabban említett thrombocyta belső szerkezetek, mivel koagulációs faktorokat, nagyszámú PDGF-et és angiogén szabályozót tartalmaznak, de trombogén funkciójuk csekély.Egyéb tényezők közé tartoznak a kevésbé jól ismert kemokin- és citokinkomponensek, mint például a 4-es thrombocyta-faktor (PF4), a vérlemezke előtti bázikus fehérje, a P-szelektin (az integrin aktivátora) és a RANTES kemokin (aktivációval szabályozzák, normális T-sejteket expresszálnak és feltehetően kiválasztó).Ezeknek a specifikus vérlemezke-granulátum-komponenseknek az általános funkciója, hogy más immunsejteket toborozzanak és aktiváljanak, vagy endothelsejt-gyulladást indukáljanak.
A sűrű szemcsés komponenseket, például az ADP-t, a szerotonint, a polifoszfátot, a hisztamint és az adrenalint implicitebben használják a vérlemezke-aktiválás és a trombózis szabályozóiként.A legfontosabb, hogy ezen elemek közül sok az immunsejteket módosítja.A thrombocyta ADP-t a dendritikus sejteken (DC) lévő P2Y12ADP receptor ismeri fel, ezáltal fokozza az antigén endocitózisát.A DC (antigénprezentáló sejt) nagyon fontos a T-sejtes immunválasz elindításához és a védő immunválasz szabályozásához, amely összekapcsolja a veleszületett immunrendszert és az adaptív immunrendszert.Ezenkívül a thrombocyta-adenozin-trifoszfát (ATP) jeleket küld a P2X7 T-sejt-receptoron keresztül, ami a CD4 T-helper sejtek fokozott differenciálódásához vezet a gyulladást okozó T-helper 17 (Th17) sejtekké.Más thrombocyta sűrű szemcsekomponensek (például glutamát és szerotonin) indukálják a T-sejtek migrációját, és növelik a monociták DC-vé történő differenciálódását.A PRP-ben ezek a sűrű részecskékből származó immunmodulátorok nagymértékben dúsítottak és jelentős immunfunkciókkal rendelkeznek.
A vérlemezkék és más (receptor) sejtek közötti közvetlen és közvetett potenciális kölcsönhatások száma kiterjedt.Ezért a PRP helyi patológiás szöveti környezetben történő alkalmazása számos gyulladásos hatást válthat ki.
A vérlemezkék koncentrációja
A C-PRP-nek koncentrált vérlemezkék klinikai dózisait kell tartalmaznia, hogy kedvező terápiás hatásokat fejtsen ki.A C-PRP-ben lévő vérlemezkék serkentik a sejtproliferációt, a mezenchimális és neurotróf faktorok szintézisét, elősegítik a kemotaktikus sejtek migrációját és serkentik az immunregulációs aktivitást, amint az az ábrán látható.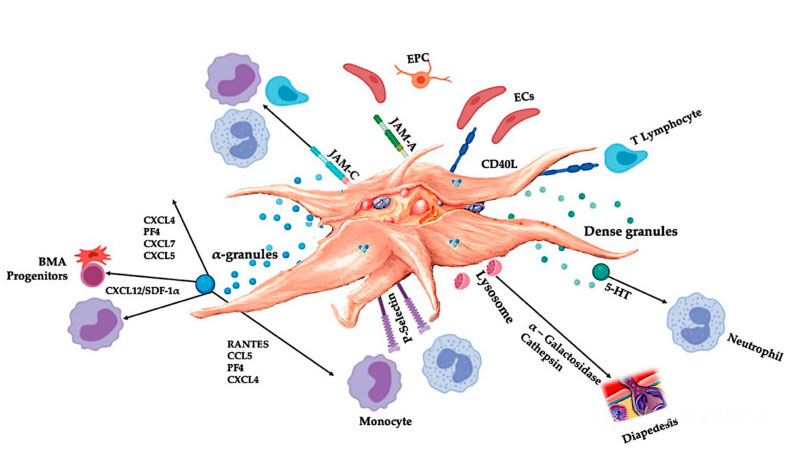
Az aktivált vérlemezkék, a PGF felszabadulása és az adhéziós molekulák számos sejtkölcsönhatást közvetítenek: kemotaxist, sejtadhéziót, migrációt és sejtdifferenciálódást, és szabályozzák az immunszabályozó aktivitást.Ezek a vérlemezke-sejt-sejt kölcsönhatások hozzájárulnak az angiogenezishez és a gyulladásos aktivitáshoz, és végső soron serkentik a szövetek helyreállítási folyamatát.Rövidítések: BMA: csontvelő aspirátum, EPC: endoteliális progenitor sejtek, EC: endoteliális sejtek, 5-HT: 5-hidroxi-triptamin, RANTES: a normál T-sejt expresszió és feltételezett szekréció aktivált szabályozása, JAM: junction adhéziós molekula típusa, CD40L: cluster 40 ligand, SDF-1 α: Stroma sejtből származó 1 α faktor, CXCL: kemokin (CXC motívum) ligand, PF4: trombocita faktor 4. Everts et al.
Marx volt az első ember, aki bebizonyította, hogy a csontok és a lágyszövetek gyógyulása javult, és a minimális vérlemezkeszám 1 × 10 6 /µL volt. Ezeket az eredményeket megerősítették a csigolyaközi nyílásokon keresztüli lumbális fúziós vizsgálat során, amikor a vérlemezke dózis nagyobb volt, mint 1,3 × 106 vérlemezke/µl értéknél ez a vizsgálat több fúziót mutatott ki.Ezenkívül Giusti et al.Kiderült, 1,5 × A szöveti helyreállító mechanizmus 109-es dózisban vérlemezkék/ml-t igényel a funkcionális angiogenezis indukálásához az endoteliális sejtaktivitáson keresztül.Az utóbbi vizsgálatban a magasabb koncentrációk csökkentették a vérlemezkék angiogenezis potenciálját a tüszőkben és azok körül.Ezenkívül a korábbi adatok azt mutatták, hogy a PRP dózisa is befolyásolja a kezelési eredményeket.Ezért az angiogenezis reakció jelentős indukálása és a sejtproliferáció és a sejtmigráció serkentése érdekében a C-PRP-nek legalább 7,5-et kell tartalmaznia egy 5 ml-es PRP-kezelőpalackban × 10 9, amely vérlemezkéket szállíthat.
A dózisfüggőség mellett a PRP sejtaktivitásra gyakorolt hatása erősen időfüggőnek tűnik.Sophie et al.Ezek az eredmények arra utalnak, hogy a humán vérlemezke-lizátumoknak való rövid távú expozíció serkentheti a csontsejtek proliferációját és a kemotaxist.Éppen ellenkezőleg, a PRP-nek való hosszú távú expozíció az alkalikus foszfatáz és az ásványi anyagok képződésének csökkenéséhez vezet.
vörösvérsejt
A vörösvértestek felelősek az oxigén szállításáért a szövetekbe és a szén-dioxid átviteléért a szövetekből a tüdőbe.Nincs magjuk, és fehérjékhez kötődő hemmolekulákból állnak.A vörösvértestekben található vas és hem összetevők elősegítik az oxigén és a szén-dioxid kombinációját.Általában a vörösvértestek életciklusa körülbelül 120 nap.Ezeket a makrofágok távolítják el a keringésből a vörösvértestek öregedésének nevezett folyamaton keresztül.A PRP-minták vörösvérsejtjei nyírási körülmények között (például teljes vérvérzéses műtét, immunmediált folyamat, oxidatív stressz vagy nem megfelelő PRP koncentrációs rendszer) károsodhatnak.Ezért a VVT sejtmembrán lebomlik, és toxikus hemoglobint (Hb) szabadít fel, amelyet plazmamentes hemoglobin (PFH), hem és vas segítségével mérnek.].A PFH és bomlástermékei (hem és vas) együttesen káros és citotoxikus hatást fejtenek ki a szövetekben, ami oxidatív stresszhez, nitrogén-monoxid-vesztéshez, gyulladásos utak aktiválásához és immunszuppresszióhoz vezet.Ezek a hatások végül a mikrokeringés zavarához, helyi érszűkülethez és érsérüléshez, valamint súlyos szövetkárosodáshoz vezetnek.
A legfontosabb dolog az, hogy amikor a C-PRP-t tartalmazó vörösvértestet a szövetbe juttatják, az eryptosisnak nevezett helyi reakciót vált ki, amely hatékony citokin és makrofág migrációt gátló hatást vált ki.Ez a citokin gátolja a monociták és makrofágok migrációját.Erős gyulladást elősegítő jeleket fejt ki a környező szövetekre, gátolja az őssejtvándorlást és a fibroblasztok proliferációját, és jelentős lokális sejtműködési zavarokhoz vezet.Ezért fontos korlátozni a VVT-szennyeződést a PRP-készítményekben.Ráadásul a vörösvérsejtek szerepét a szövetek regenerációjában soha nem határozták meg.A megfelelő C-PRP centrifugálás és előkészítés általában csökkenti vagy akár teljesen megszünteti a vörösvértestek jelenlétét, így elkerülhető a hemolízis és a policitémia káros következményei.
Leukociták a C-PRP-ben
A fehérvérsejtek jelenléte a PRP-készítményekben a kezelési berendezéstől és az előkészítési sémától függ.A plazma alapú PRP berendezésekben a fehérvérsejtek teljesen megszűnnek;A fehérvérsejtek azonban szignifikánsan koncentrálódtak az eritrocita ülepedési barna réteg PRP preparátumában.Immun- és gazdaszervezet védekező mechanizmusa miatt a fehérvérsejtek nagymértékben befolyásolják az akut és krónikus szöveti állapotok belső biológiáját.Ezeket a funkciókat az alábbiakban részletesebben tárgyaljuk.Ezért a specifikus leukociták jelenléte a C-PRP-ben jelentős sejtes és szöveti hatásokat okozhat.Pontosabban, a különböző PRP eritrocita szedimentációs barna-sárga rétegrendszerek különböző előkészítési sémákat alkalmaznak, így a PRP-ben eltérő arányban termelnek neutrofileket, limfociták és monociták.Az eozinofilek és bazofilek nem mérhetők a PRP-készítményekben, mert sejtmembránjaik túl sérülékenyek ahhoz, hogy ellenálljanak a centrifugális feldolgozási erőknek.
Neutrophilek
A neutrofilek esszenciális leukociták számos gyógyulási folyamatban.Ezek az útvonalak a vérlemezkékben jelenlévő antimikrobiális fehérjékkel kombinálva sűrű gátat képeznek az invazív kórokozókkal szemben.A neutrofilek létezését a C-PRP kezelési céljának megfelelően határozzuk meg.A krónikus sebkezelés PRP bioterápiájában vagy a csontnövekedést vagy gyógyulást célzó alkalmazásokban fokozott szöveti gyulladásra lehet szükség.Fontos, hogy több modellben további neutrofil funkciókat találtak, hangsúlyozva ezek szerepét az angiogenezisben és a szövetek helyreállításában.A neutrofilek azonban káros hatásokat is okozhatnak, ezért bizonyos alkalmazásokra nem alkalmasak.Zhou és Wang bebizonyította, hogy a neutrofilekben gazdag PRP használata a III-as típusú kollagén és az I-es típusú kollagén arányának növekedéséhez vezethet, ezáltal súlyosbítja a fibrózist és csökkenti az inak szilárdságát.A neutrofilek által közvetített további káros jellemzők a gyulladásos citokinek és mátrix metalloproteinázok (MMP) felszabadulása, amelyek elősegíthetik a gyulladást és a katabolizmust, ha szövetekre alkalmazzák.
Leukomonocita
A C-PRP-ben a mononukleáris T- és B-limfociták koncentráltabbak, mint bármely más fehérvérsejt.Ezek szorosan kapcsolódnak a sejt által közvetített citotoxikus adaptív immunitáshoz.A limfociták sejtreakciókat válthatnak ki, hogy leküzdjék a fertőzést és alkalmazkodjanak a betolakodókhoz.Emellett a T-limfocitákból származó citokinek (interferon-γ [IFN-γ] és interleukin-4 (IL-4)) fokozzák a makrofágok polarizációját. Verassar és mtsai. Bebizonyosodott, hogy a hagyományos T-limfociták közvetve elősegíthetik a szövetek gyógyulását. az egérmodell a monociták és makrofágok differenciálódásának szabályozásával.
Monocita – multipotens javító sejt
Az alkalmazott PRP előkészítő eszköztől függően előfordulhat, hogy a monociták kinyúlnak a PRP kezelőpalackban, vagy nem léteznek.Sajnos teljesítményükről és regenerációs képességükről ritkán esik szó a szakirodalomban.Ezért az előállítási módszerben vagy a végső képletben kevés figyelmet fordítanak a monocitákra.A monocitacsoport heterogén, a csontvelő progenitor sejtjeiből származik, és a mikrokörnyezeti stimulációnak megfelelően a hematopoietikus őssejt-útvonalon keresztül a perifériás szövetekbe kerül.A homeosztázis és a gyulladás során a keringő monociták elhagyják a véráramot, és a sérült vagy leromlott szövetekbe toboroznak.Makrofágokként (M Φ) effektorsejtekként vagy progenitorsejtekként működhetnek.A monociták, makrofágok és dendritikus sejtek képviselik a mononukleáris fagocita rendszert (MPS). Az MPS tipikus jellemzője a génexpressziós mintázat plaszticitása és az ezen sejttípusok közötti funkcionális átfedés.A degenerált szövetekben a rezidens makrofágok, lokálisan ható növekedési faktorok, gyulladást elősegítő citokinek, apoptotikus vagy nekrotikus sejtek és mikrobiális termékek indítják el a monocitákat, hogy MPS sejtcsoportokká differenciálódjanak.Tegyük fel, hogy ha C-PRP-t tartalmazó nagy hozamú monocitákat injektálnak a betegség lokális mikrokörnyezetébe, a monociták valószínűleg M Φ-vé differenciálódnak, és jelentős sejtelváltozásokat okoznak.
Monocitából M Φ Az átalakulás folyamatában specifikus M Φ Fenotípus.Az elmúlt tíz évben olyan modellt fejlesztettek ki, amely integrálja M Φ Az aktiválás összetett mechanizmusát két ellentétes állapot polarizációjaként írják le: M Φ 1. fenotípus (M Φ 1, klasszikus aktiválás) és M Φ 2. fenotípus (M Φ) 2, alternatív aktiválás).Az M Φ 1-re jellemző a gyulladásos citokin szekréció (IFN-γ) és a nitrogén-monoxid, amelyek hatékony kórokozó-ölő mechanizmust hoznak létre.M Φ A fenotípus vaszkuláris endoteliális növekedési faktort (VEGF) és fibroblaszt növekedési faktort (FGF) is termel.M Φ A fenotípus magas fagocitózisú gyulladásgátló sejtekből áll.M Φ 2 Extracelluláris mátrix komponenseket, angiogenezist és kemokineket, valamint interleukin 10-et (IL-10) termel.A kórokozók elleni védekezés mellett M Φ Csökkentheti a gyulladást és elősegítheti a szövetek helyreállítását is.Figyelemre méltó, hogy M Φ 2 -t M in vitro Φ 2a、M Φ 2b és M Φ 2 -re osztották fel. Ez az ingertől függ.Ezen altípusok in vivo transzlációja nehéz, mivel a szövet kevert M Φ csoportokat tartalmazhat.Érdekes módon a helyi környezeti jelek és az IL-4 szintek alapján a proinflammatorikus M Φ 1 átalakítható az M Φ 2 javításának elősegítésére. Ezekből az adatokból ésszerűen feltételezhető, hogy a monociták és az M Φ C-PRP preparátumok magas koncentrációban vannak jelen. hozzájárulhatnak a szövetek jobb helyreállításához, mivel gyulladásgátló szövetjavító és sejtjelátviteli képességekkel rendelkeznek.
A fehérvérsejt-frakció zavaros meghatározása a PRP-ben
A fehérvérsejtek jelenléte a PRP kezelőpalackokban a PRP előkészítő eszköztől függ, és jelentős eltérések lehetnek.Sok vita folyik a leukociták létezéséről és a különböző al-PRP-termékekhez való hozzájárulásukról (például PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF és L-PRF) Egy közelmúltbeli áttekintésben hat randomizált kontrollos vizsgálatokban (1. evidenciaszint) és három prospektív összehasonlító vizsgálatban (2. evidenciaszint) 1055 beteg vett részt, ami azt jelzi, hogy az LR-PRP és az LP-PRP biztonságossága hasonló.A szerző arra a következtetésre jutott, hogy a PRP mellékhatása nem feltétlenül függ közvetlenül a fehérvérsejtek koncentrációjától.Egy másik vizsgálatban az LR-PRP nem változtatta meg a gyulladásos interleukin (IL-1) szintjét az OA térd β, IL-6, IL-8 és IL-17 esetében.Ezek az eredmények alátámasztják azt a nézetet, hogy a leukociták szerepe a PRP biológiai aktivitásában in vivo a vérlemezkék és a leukociták közötti áthallásból származhat.Ez a kölcsönhatás elősegítheti más tényezők (például lipoxigén) bioszintézisét, amely ellensúlyozhatja vagy elősegítheti a gyulladás visszafejlődését.A gyulladásos molekulák (arachidonsav, leukotrién és prosztaglandin) kezdeti felszabadulása után lipoxigén A4 szabadul fel az aktivált vérlemezkékből, hogy megakadályozza a neutrofilek aktiválódását.Ebben a környezetben az M Φ fenotípus M Φ 1-ről átvált M Φ 2-re. Ráadásul egyre több bizonyíték áll rendelkezésre arra vonatkozóan, hogy a keringő mononukleáris sejtek pluripotenciájuk miatt különféle nem fagocita sejttípusokká differenciálódhatnak.
A PRP típusa hatással lesz az MSC-tenyészetre.A tiszta PRP vagy PPP mintákkal összehasonlítva az LR-PRP a csontvelőből származó MSC-k (BMMSC) szignifikánsan nagyobb proliferációját képes indukálni, gyorsabb felszabadulással és jobb PGF biológiai aktivitással.Mindezek a tulajdonságok elősegítik a monociták hozzáadását a PRP kezelőpalackba, és felismerik immunmoduláló képességüket és differenciálódási potenciáljukat.
A PRP veleszületett és adaptív immunszabályozása
A vérlemezkék leghíresebb élettani funkciója a vérzés szabályozása.Felhalmozódnak a szövetkárosodás helyén és a sérült erekben.Ezeket az eseményeket az integrinek és szelektinek expressziója okozza, amelyek serkentik a vérlemezkék adhézióját és aggregációját.A károsodott endotélium tovább súlyosbítja ezt a folyamatot, a szabaddá vált kollagén és más szubendoteliális mátrix fehérjék pedig elősegítik a vérlemezkék mély aktiválódását.Ezekben az esetekben a von Willebrand faktor (vWF) és a glikoprotein (GP), különösen a GP-Ib közötti interakció fontos szerepe igazolódott.A thrombocyta aktivációt követően a thrombocyta α-、 sűrű, lizoszómás és T-granulátumok szabályozzák az exocitózist és tartalmukat az extracelluláris környezetbe juttatják.
Vérlemezke adhéziós molekula
Ahhoz, hogy jobban megértsük a PRP gyulladásos szövetekben és vérlemezkékben betöltött szerepét az immunválaszban, meg kell értenünk, hogy a különböző vérlemezke felszíni receptorok (integrinek) és junction adhéziós molekulák (JAM) és sejtkölcsönhatások hogyan indíthatnak el kritikus folyamatokat a veleszületett és adaptív immunitásban.
Az integrinek olyan sejtfelszíni adhéziós molekulák, amelyek különféle sejttípusokban találhatók, és nagy mennyiségben expresszálódnak a vérlemezkéken.Az integrinek közé tartozik az a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) és aIIbb3 (GPIIb/IIIa).Általában statikus és alacsony affinitású állapotban léteznek.Az aktiválás után átváltanak a magas ligandumkötő affinitás állapotába.Az integrinek különböző funkciót töltenek be a vérlemezkéken, és részt vesznek a vérlemezkék kölcsönhatásában többféle fehérvérsejttel, endothel sejtekkel és extracelluláris mátrixszal.Ezenkívül a GP-Ib-V-IX komplex expresszálódik a vérlemezke membránján, és ez a fő receptor a von vWF-hez való kötődéshez.Ez a kölcsönhatás közvetíti a kezdeti érintkezést a vérlemezkék és a szabaddá vált szubendoteliális struktúrák között.A thrombocyta integrin és a GP komplex különböző gyulladásos folyamatokhoz kapcsolódik, és fontos szerepet játszik a vérlemezke-leukocita komplex kialakulásában.Pontosabban, az aIIbb3 integrin szükséges egy stabil komplex kialakításához a fibrinogén és a neutrofileken lévő makrofág 1 antigén (Mac-1) receptor kombinálásával.
A vérlemezkék, a neutrofilek és a vaszkuláris endothel sejtek specifikus sejtadhéziós molekulákat, úgynevezett szelektint expresszálnak.Gyulladásos körülmények között a vérlemezkék P-szelektint és neutrofil L-szelektint expresszálnak.A vérlemezkék aktiválása után a P-szelektin kötődhet a PSGL-1 ligandumhoz, amely a neutrofileken és a monocitákon található.Ezenkívül a PSGL-1 kötődés intracelluláris jelkaszkád reakciót indít el, amely aktiválja a neutrofileket a neutrofil integrin Mac-1 és a limfocita funkcióval kapcsolatos antigén 1 (LFA-1) révén.Az aktivált Mac-1 a fibrinogénen keresztül kötődik a vérlemezkék GPIb-hez vagy GPIIb/IIIa-hoz, így stabilizálja a neutrofilek és a vérlemezkék közötti kölcsönhatást.Ezenkívül az aktivált LFA-1 kombinálódhat a 2-es thrombocyta intercelluláris adhéziós molekulával, hogy tovább stabilizálja a neutrofil-thrombocyta komplexet, és elősegítse a sejtekhez való hosszú távú adhéziót.
A vérlemezkék és a leukociták kulcsszerepet játszanak a veleszületett és adaptív immunválaszokban
A szervezet felismeri az idegen testeket és a sérült szöveteket akut vagy krónikus betegségekben, hogy elindítsa a sebgyógyulási kaszkád reakciót és a gyulladásos folyamatot.A veleszületett és adaptív immunrendszer megvédi a gazdát a fertőzésektől, a fehérvérsejtek pedig fontos szerepet játszanak a két rendszer átfedésében.Pontosabban, a monociták, makrofágok, neutrofilek és természetes gyilkos sejtek kulcsszerepet játszanak a veleszületett rendszerben, míg a limfociták és alcsoportjaik hasonló szerepet játszanak az adaptív immunrendszerben.
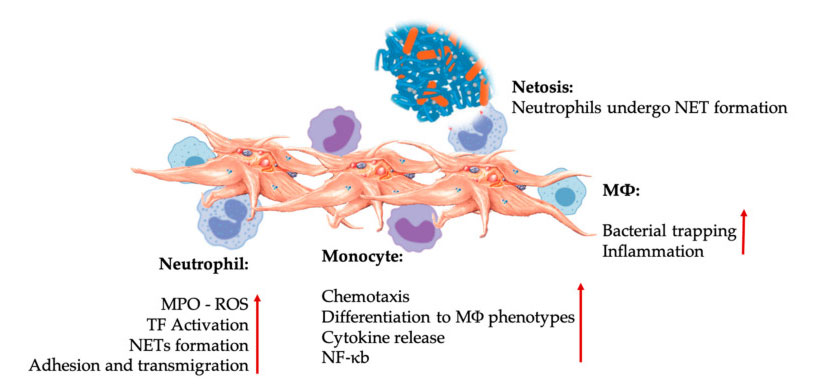
Thrombocyta és leukocita kölcsönhatások veleszületett immunsejt-kölcsönhatásokban.A vérlemezkék kölcsönhatásba lépnek a neutrofilekkel és a monocitákkal, végül az M Φ kölcsönhatásba lépnek, beállítják és növelik effektor funkcióikat.Ezek a vérlemezke-leukocita kölcsönhatások különböző mechanizmusokon, köztük a NETosison keresztül gyulladáshoz vezetnek.Rövidítések: MPO: mieloperoxidáz, ROS: reaktív oxigénfajták, TF: szöveti faktor, NET: neutrofil extracelluláris csapda, NF- κ B: Nukleáris faktor kappa B, M Φ: Makrofágok.
Veleszületett immunrendszer
A veleszületett immunrendszer szerepe az, hogy nem specifikusan azonosítsa az invazív mikroorganizmusokat vagy szövetfragmenseket, és stimulálja kiürülésüket.Amikor bizonyos molekuláris struktúrák, az úgynevezett felszíni expressziós mintázatfelismerő receptorok (PRR-ek) kombinálódnak a kórokozókkal kapcsolatos molekuláris mintákkal és a károsodással kapcsolatos molekuláris mintákkal, a veleszületett immunrendszer aktiválódik.Sokféle PRR létezik, köztük a Toll-like receptor (TLR) és a RIG-1-szerű receptor (RLR).Ezek a receptorok aktiválhatják a fő transzkripciós faktort, a kappa B-t (NF-κ B). A veleszületett és adaptív immunválasz több aspektusát is szabályozza.Érdekes módon a vérlemezkék számos immunszabályozó receptor molekulát is expresszálnak a felületükön és a citoplazmájukon, mint például a P-szelektin, transzmembrán fehérje CD40 ligandum (CD40L), citokinek (például IL-1 β、 TGF- β) és vérlemezke-specifikus TLR). Ezért a vérlemezkék kölcsönhatásba léphetnek különféle immunsejtekkel.
A vérlemezke-fehérsejt kölcsönhatás a veleszületett immunitásban
Amikor a vérlemezkék belépnek a véráramba vagy szövetbe, vagy behatolnak a vérbe, a vérlemezkék azok a sejtek, amelyek először észlelik az endothel sérülését és a mikrobiális kórokozókat.Thrombocyta aggregáció és elősegíti az ADP, trombin és vWF thrombocyta-agonisták felszabadulását, ami vérlemezke aktiválódást és a C, CC, CXC és CX3C vérlemezke-kemokin receptorok expresszióját eredményezi, így vérlemezkék kialakulását okozva a fertőzött helyen vagy sérülést.
A veleszületett immunrendszer genetikailag előre meghatározott, hogy felismerje a betolakodókat, például vírusokat, baktériumokat, parazitákat és toxinokat, vagy szöveti sebeket és sebeket.Ez egy nem specifikus rendszer, mivel minden kórokozót idegenként vagy nem sajátként azonosítanak, és gyorsan megtalálják.A veleszületett immunrendszer fehérjékre és fagocitákra támaszkodik, amelyek felismerik a kórokozók jól megőrzött tulajdonságait, és gyorsan aktiválják az immunválaszt a betolakodók eltávolítására, még akkor is, ha a gazdaszervezet korábban soha nem volt kitéve meghatározott kórokozóknak.
A neutrofilek, a monociták és a dendritikus sejtek a leggyakoribb veleszületett immunsejtek a vérben.Felvételük szükséges a megfelelő korai immunválaszhoz.Amikor a PRP-t a regeneratív gyógyászatban alkalmazzák, a vérlemezke-fehérsejt kölcsönhatás szabályozza a gyulladást, a sebgyógyulást és a szövetek helyreállítását.A vérlemezkéken lévő TLR-4 serkenti a thrombocyta-neutrofil kölcsönhatást, amely szabályozza az úgynevezett leukocita oxidatív robbanást azáltal, hogy szabályozza a reaktív oxigénfajták (ROS) és a mieloperoxidáz (MPO) felszabadulását a neutrofilekből.Ezenkívül a thrombocyta-neutrofil és a neutrofil degranuláció közötti kölcsönhatás neutrofil-extracelluláris csapdák (NET) kialakulásához vezet.A NET-ek neutrofil sejtmagból és más neutrofil intracelluláris tartalomból állnak, amelyek képesek elkapni a baktériumokat és elpusztítani őket a NETosison keresztül.A NET-ek kialakulása a neutrofilek alapvető elpusztító mechanizmusa.
A thrombocyta aktivációt követően a monociták a beteg és degeneratív szövetekbe vándorolhatnak, ahol adhéziós aktivitást folytatnak, és gyulladásos molekulákat választanak ki, amelyek megváltoztathatják a kemotaxist és a proteolitikus tulajdonságokat.Ezenkívül a vérlemezkék monocita NF-κ B aktivációt indukálhatnak a monociták effektor funkciójának szabályozására, amely a gyulladásos válasz, valamint az immunsejtek aktiválásának és differenciálódásának kulcsfontosságú közvetítője.A vérlemezkék tovább segítik a monociták endogén oxidatív robbanását, hogy elősegítsék a fagocita kórokozók elpusztítását.Az MPO felszabadulását a vérlemezke-monocita CD40L-MAC-1 közvetlen kölcsönhatása közvetíti.Érdekes módon, amikor a P-szelektin aktiválja a vérlemezkéket akut és krónikus gyulladásos szöveti állapotok esetén, a vérlemezkéből származó kemokinek, a PF4, RANTES, IL-1 β és CXCL-12 megakadályozhatják a monociták spontán apoptózisát, de elősegítik azok makrofágokká történő differenciálódását.
Adaptív immunrendszer
Miután a nem specifikus veleszületett immunrendszer felismeri a mikrobiális vagy szöveti károsodást, a specifikus adaptív immunrendszer veszi át az irányítást.Az adaptív rendszerek közé tartoznak az antigénkötő B-limfociták (B-sejtek) és a hagyományos T-limfociták (Treg), amelyek koordinálják a kórokozók eltávolítását.A T-sejtek nagyjából feloszthatók helper T-sejtekre (Th-sejtek) és citotoxikus T-sejtekre (Tc-sejtek, más néven T-gyilkos sejtek).A Th-sejteket tovább osztják Th1, Th2 és Th17 sejtekre, amelyek kulcsfontosságú szerepet töltenek be a gyulladásban.A Th sejtek proinflammatorikus citokineket (pl. IFN- γ、 TNF- β) és számos interleukint (pl. IL-17) szekretálhatnak. Különösen hatékonyak az intracelluláris vírus- és bakteriális fertőzés megelőzésében. A Th sejtek serkentik a sejtek proliferációját és differenciálódását A Tc sejtek effektor sejtek, amelyek képesek eltávolítani a célzott intracelluláris és extracelluláris mikroorganizmusokat és sejteket.
Érdekes módon a Th2 sejtek IL-4-et termelnek és befolyásolják az M Φ polarizációt, az M Φ Irányított regenerációt az M Φ 2 fenotípust, míg az IFN- γ M Φ gyulladásos M Φ 1 fenotípussá változnak, ami a citokinek dózisától és idejétől függ.Az IL-4 aktiválása után az MΦ2 a Treg-sejteket Th2-sejtekké való differenciálódásra indukálja, majd további IL-4-et termel (pozitív visszacsatolási hurok).A Th sejtek átalakítják az M Φ-t A fenotípus a regeneratív fenotípus felé irányul, válaszul a szöveti eredetű biológiai ágensekre.Ez a mechanizmus azon a bizonyítékokon alapul, hogy a Th-sejtek jelentős szerepet játszanak a gyulladás szabályozásában és a szövetek helyreállításában.
Thrombocyta-fehérsejt kölcsönhatás az adaptív immunitásban
Az adaptív immunrendszer antigén-specifikus receptorokat használ, emlékszik a korábban talált kórokozókra, és elpusztítja azokat, amikor a gazdaszervezettel találkozik.Ezek az adaptív immunválaszok azonban lassan fejlődtek ki.Konias et al.Azt mutatja, hogy a thrombocyta komponens hozzájárul a kockázat észleléséhez és a szövetek helyreállításához, valamint hogy a vérlemezkék és a leukociták közötti kölcsönhatás elősegíti az adaptív immunválasz aktiválódását.
Az adaptív immunválasz során a vérlemezkék elősegítik a monocita és makrofág válaszokat a DC és NK sejtek érése révén, ami specifikus T sejt és B sejt válaszokhoz vezet.Ezért a thrombocyta granulátum komponensei közvetlenül befolyásolják az adaptív immunitást azáltal, hogy expresszálják a CD40L-t, egy olyan molekulát, amely elengedhetetlen az adaptív immunválasz szabályozásához.A CD40L-en keresztül a vérlemezkék nemcsak az antigénprezentációban játszanak szerepet, hanem befolyásolják a T-sejt reakciókat is.Liu et al.Azt találták, hogy a vérlemezkék komplex módon szabályozzák a CD4 T-sejtes választ.A CD4 T-sejt-alcsoportok eltérő szabályozása azt jelenti, hogy a vérlemezkék elősegítik, hogy a CD4 T-sejtek reagáljanak a gyulladásos ingerekre, így erős gyulladásgátló és gyulladásgátló reakciókat váltanak ki.
A vérlemezkék szabályozzák a B-sejtek által közvetített adaptív választ is a mikrobiális kórokozókra.Jól ismert, hogy az aktivált CD4 T-sejteken lévő CD40L kiváltja a B-sejtek CD40-ét, biztosítva a második jelet, amely a T-sejt-függő B-limfocita aktiváláshoz, az ezt követő allotípus-konverzióhoz, valamint a B-sejtek differenciálódásához és proliferációjához szükséges.Általánosságban elmondható, hogy az eredmények egyértelműen mutatják a vérlemezkék különféle funkcióit az adaptív immunitásban, jelezve, hogy a vérlemezkék a CD40-CD40L-en keresztül kapcsolják össze a T-sejtek és a B-sejtek közötti kölcsönhatást, ezáltal fokozzák a T-sejt-függő B-sejtes választ.Emellett a vérlemezkék gazdagok sejtfelszíni receptorokban, amelyek elősegíthetik a vérlemezke aktivációt, és nagyszámú gyulladásos és biológiailag aktív molekulát szabadíthatnak fel, amelyek különböző thrombocytarészecskékben raktározódnak, így befolyásolva a veleszületett és adaptív immunválaszt.
A thrombocyta eredetű szerotonin szerepének növekedése a PRP-ben
A szerotonin (5-hidroxi-triptamin, 5-HT) egyértelműen kulcsszerepet játszik a központi idegrendszerben (CNS), beleértve a fájdalomtűrést is.Becslések szerint a humán 5-HT nagy része a gyomor-bél traktusban, majd a vérkeringésben termelődik, ahol a vérlemezkék a szerotonin újrafelvétel transzporterén keresztül szívódnak fel, és sűrű részecskékben, nagy koncentrációban (65 mmol/L) tárolódnak.Az 5-HT egy jól ismert neurotranszmitter és hormon, amely segít a központi idegrendszer különböző neuropszichológiai folyamatainak szabályozásában (centrális 5-HT).Az 5-HT nagy része azonban a központi idegrendszeren kívül létezik (perifériás 5-HT), és több szervrendszer szisztémás és sejtbiológiai funkcióinak szabályozásában vesz részt, beleértve a szív- és érrendszeri, tüdő-, gasztrointesztinális, urogenitális és vérlemezke-funkcionális rendszereket.Az 5-HT koncentrációfüggő metabolizmussal rendelkezik számos sejttípuson, beleértve a zsírsejteket, hámsejteket és fehérvérsejteket.A perifériás 5-HT egyben erős immunmodulátor is, amely specifikus 5-HT receptorán (5HTR) keresztül stimulálhatja vagy gátolja a gyulladást, és különböző immunsejtekre hat.
A HT parakrin és autokrin mechanizmusa
Az 5-HT aktivitását az 5HTR-ekkel való kölcsönhatás közvetíti, amely egy szupercsalád hét taggal (5-HT 1 – 7) és legalább 14 különböző receptor altípussal, köztük a nemrég felfedezett 5-HT 7 taggal, annak perifériás, ill. funkciója a fájdalom kezelésében.A thrombocyta degranuláció folyamatában az aktivált vérlemezkék nagyszámú vérlemezkéből származó 5-HT-t választanak ki, amely elősegítheti az érösszehúzódást, és serkentheti a szomszédos vérlemezkék és limfociták aktivációját az 5-HTR expressziója révén az endotélsejteken, simaizomsejteken és immunsejtek.Pacala et al.Vizsgálták az 5-HT vaszkuláris endotélsejtekre kifejtett mitotikus hatását, és meghatározták a sérült erek növekedésének elősegítését az angiogenezis stimulálásával.Ezeknek a folyamatoknak a szabályozása nem teljesen világos, de a szöveti mikroáramkörben differenciált kétirányú jelutakat foglalhat magában, amelyek szabályozzák a vaszkuláris endotélsejtek és a simaizomsejtek, a fibroblasztok és az immunsejtek funkcióit az ezeken a sejteken található specifikus 5-HT receptorokon keresztül. .Leírták a thrombocyta 5-HT autokrin funkcióját a vérlemezke aktiválás után [REF].Az 5-HT felszabadulása fokozza a vérlemezkék aktiválódását és a keringő vérlemezkék toborzását, ami a jelkaszkád reakciók és a vérlemezke reaktivitást támogató upstream effektorok aktiválásához vezet.
Immunmoduláló 5-HT hatás
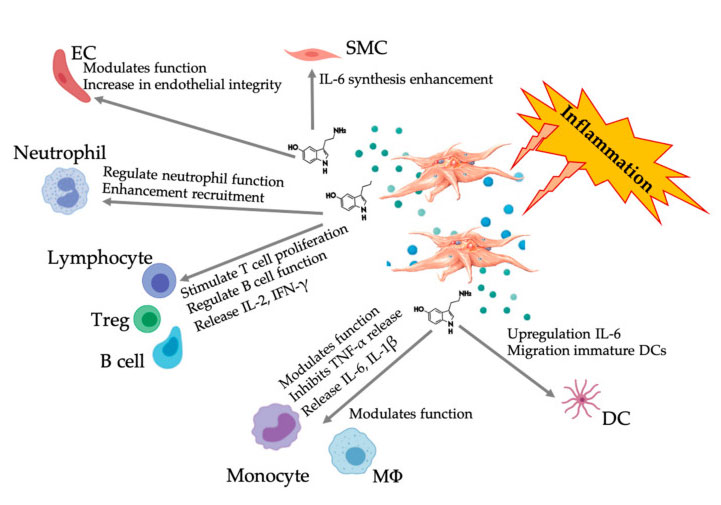
Egyre több bizonyíték bizonyítja, hogy a szerotonin szerepet játszhat a különböző 5HTR-ekben, mint immunmodulátor.A gyulladásos reakcióban részt vevő különböző leukocitákban kifejeződő 5HTR szerint a vérlemezkéből származó 5-HT immunszabályozóként működik mind a veleszületett, mind az adaptív immunrendszerben.Az 5-HT serkentheti a Treg proliferációt, és szabályozhatja a B-sejtek, a természetes gyilkos sejtek és a neutrofilek funkcióit azáltal, hogy DC-t és monocitákat toboroz a gyulladásos helyre.A legújabb vizsgálatok kimutatták, hogy a vérlemezkékből származó 5-HT képes szabályozni az immunsejtek működését bizonyos körülmények között.Ezért a C-PRP használatával a vérlemezke-koncentráció nagyobb, mint 1 × 10 6/µl, jelentősen elősegítheti a nagy vérlemezkékből származó 5-HT koncentrációnak a szövetekbe történő szállítását.A gyulladásos komponensekkel jellemezhető mikrokörnyezetben a PRP számos olyan immunsejttel kölcsönhatásba léphet, amelyek kulcsszerepet játszanak ezekben a patológiákban, ami befolyásolhatja a klinikai eredményeket.
Az ábra a sokrétű 5-HT választ mutatja a gyulladásos PRP vérlemezkék aktiválása után.A vérlemezkék aktiválódása után a vérlemezkék felszabadítják szemcséiket, köztük sűrű granulátumban az 5-HT-t, amely széleskörű differenciális hatást fejt ki a különböző immunsejtekre, endotélsejtekre és simaizomsejtekre.Rövidítések: SMC: simaizomsejtek, EC: endoteliális sejtek, Treg: hagyományos T-limfociták, M Φ: makrofágok, DC: dendritikus sejtek, IL: interleukin, IFN-γ: interferon γ. Módosítva és adaptálva Everts et al.és Hull és mtsai.
A PRP fájdalomcsillapító hatása
Az aktivált vérlemezkék számos gyulladáscsökkentő és gyulladásgátló mediátort szabadítanak fel, amelyek nemcsak fájdalmat okozhatnak, hanem csökkentik a gyulladást és a fájdalmat is.Alkalmazása után a PRP tipikus vérlemezke-dinamikája megváltoztatja a mikrokörnyezetet a szövetek helyreállítása és regenerációja előtt az anabolizmushoz és katabolizmushoz, sejtproliferációhoz, differenciálódáshoz és őssejt-szabályozáshoz kapcsolódó összetett folyamatok révén.A PRP ezen jellemzői a PRP alkalmazásához vezetnek különféle, általában krónikus fájdalommal járó klinikai patológiás állapotokban (például sportsérülések, ortopédiai betegségek, gerincbetegségek és összetett krónikus sebek), bár a pontos mechanizmus még nem teljesen tisztázott.
2008-ban Evertz et al.Ez az első randomizált kontrollos vizsgálat, amely az autológ eritrocita ülepedési ráta barna rétegéből előállított és vállműtét után autológ trombinnal aktivált PRP készítmény fájdalomcsillapító hatásáról számolt be.Megfigyelték a vizuális analóg skála pontszámainak jelentős csökkenését, az opioid alapú fájdalomcsillapítók alkalmazását és a sikeresebb posztoperatív rehabilitációt.Figyelemre méltó, hogy az aktivált vérlemezkék fájdalomcsillapító hatását tükrözik, és az 5-HT-t felszabadító vérlemezkék mechanizmusára spekulálnak.Röviden: a vérlemezkék alvó állapotban vannak a frissen készített PRP-ben.A vérlemezkék közvetlen vagy közvetett aktiválása (szöveti faktor) után a vérlemezkék alakjukat változtatják, és elég hamisat termelnek ahhoz, hogy elősegítsék a vérlemezke-aggregációt.Ezután intracelluláris α- és sűrű részecskéket szabadítanak fel.Az aktivált PRP-vel kezelt szövetet PGF, citokinek és más vérlemezke-lizoszómák támadják meg.Pontosabban, amikor a sűrű részecskék felszabadítják tartalmukat, nagy mennyiségű 5-HT-t bocsátanak ki, amely szabályozza a fájdalmat.A C-PRP-ben a vérlemezke-koncentráció 5-7-szer magasabb, mint a perifériás vérben.Ezért az 5-HT felszabadulása a vérlemezkékből csillagászati.Érdekes módon Sprott et al.A jelentés megállapította, hogy a fájdalom szignifikánsan enyhült az akupunktúra és a moxibuszció után, a vérlemezkéből származó 5-HT koncentrációja szignifikánsan csökkent, majd az 5-HT plazmaszintje emelkedett.
A perifériás területen a vérlemezkék, a hízósejtek és az endotélsejtek endogén 5-HT-t szabadítanak fel szövetsérülés vagy műtéti trauma során.Érdekes módon a neuronok 5-HT receptorait detektálták a perifériás területen, ami megerősítette, hogy az 5-HT zavarhatja a nociceptív átvitelt a perifériás területen.Ezek a vizsgálatok azt mutatják, hogy az 5-HT befolyásolhatja a perifériás szövetek nociceptív átvitelét az 5-HT1, 5-HT2, 5-HT3, 5-HT4 és 5-HT7 receptorokon keresztül.
Az 5-HT rendszer egy hatékony rendszer, amely csökkenti és növeli a fájdalmat a káros stimuláció után.A nociceptív jelek központi és perifériás szabályozásáról és az 5-HT rendszer változásáról számoltak be krónikus fájdalomban szenvedő betegeknél.Az elmúlt években számos tanulmány összpontosított az 5-HT és megfelelő receptorainak szerepére a káros információk feldolgozásában és szabályozásában, ami olyan gyógyszereket eredményezett, mint a szelektív szerotonin újrafelvétel-gátlók (SSRI).Ez a gyógyszer gátolja a szerotonin újrafelvételét a preszinaptikus neuronokba a szerotonin felszabadulása után.Befolyásolja a szerotonin kommunikáció időtartamát és intenzitását, és a krónikus fájdalom alternatív kezelése.További klinikai kutatásokra van szükség ahhoz, hogy világosan megértsük a PRP-eredetű 5-HT fájdalomszabályozás molekuláris mechanizmusát krónikus és degeneratív betegségekben.
További adatok a PRP potenciális fájdalomcsillapító hatásának megoldására a fájdalomcsillapító állatmodell-teszt után szerezhetők be.Ezekben a modellekben az összehasonlító statisztikai következtetések kihívást jelentenek, mivel ezek a tanulmányok túl sok változót tartalmaznak.Ennek ellenére néhány klinikai tanulmány foglalkozott a PRP nociceptív és fájdalomcsillapító hatásaival.Számos tanulmány kimutatta, hogy a tendinosis vagy a rotátorköpeny-szakadás miatt kezelt betegek fájdalomcsillapítása csekély.Ezzel szemben számos más tanulmány kimutatta, hogy a PRP csökkentheti vagy akár megszüntetheti az índegenerációban, az OA-ban, a plantar fasciitisben és más láb- és bokabetegségben szenvedő betegek fájdalmát.A végső thrombocyta-koncentrációt és a biológiai sejtösszetételt határozták meg a PRP kulcsfontosságú jellemzőiként, amelyek segítenek a PRP alkalmazása utáni állandó fájdalomcsillapító hatás megfigyelésében.Egyéb változók közé tartozik a PRP bejuttatási módja, az alkalmazási technológia, a vérlemezke aktiválási protokoll, a PGF és a felszabadult citokinek biológiai aktivitási szintje, a PRP alkalmazásának szövettípusa és a sérülés típusa.
Figyelemre méltó, hogy Kuffler megoldotta a PRP-ben rejlő lehetőségeket a fájdalom csillapításában olyan betegeknél, akik enyhe vagy súlyos krónikus neuropátiás fájdalomban szenvednek, másodlagosan a sérült nem regeneratív ideg miatt.A tanulmány célja annak vizsgálata, hogy a neuropátiás fájdalom csökkenthető-e vagy csillapítható-e a PRP hatására, amely elősegíti az axonális regenerációt és a célideg reinnervációját.Meglepő módon a kezelésben részesülő betegek körében a neuropátiás fájdalom még legalább hat évvel a műtét után megszűnik vagy enyhül.Ezenkívül a PRP alkalmazása után három héten belül minden beteg elkezdett csillapítani a fájdalmat.
Az utóbbi időben hasonló fájdalomcsillapító PRP hatásokat figyeltek meg a posztoperatív seb- és bőrápolás területén.Érdekes módon a szerzők beszámoltak az érsérüléssel és a bőrszöveti hipoxiával kapcsolatos sebfájdalom fiziológiai vonatkozásairól.Megvitatták az angiogenezis jelentőségét is az oxigénellátás és a tápanyagszállítás optimalizálása szempontjából.Vizsgálatuk kimutatta, hogy a kontrollcsoporthoz képest a PRP-kezelésben részesülő betegek kevesebb fájdalmat és szignifikánsan megnövekedett angiogenezist tapasztaltak.Végül Johal és munkatársai szisztematikus áttekintést és metaanalízist végeztek, és arra a következtetésre jutottak, hogy a PRP csökkentheti a fájdalmat a PRP ortopédiai indikációkban történő alkalmazása után, különösen azoknál a betegeknél, akik külső epicondylitis és térd OA kezelésben részesülnek.Sajnos ez a tanulmány nem határozta meg a fehérvérsejtek, a thrombocyta-koncentráció vagy az exogén thrombocyta aktivátorok hatását, mivel ezek a változók befolyásolnák a PRP általános hatékonyságát.Az optimális PRP vérlemezke-koncentráció a maximális fájdalomcsillapítás érdekében nem világos.A tendinosis patkánymodelljében a vérlemezkekoncentráció 1,0 × 10 6 / μ L-nél a fájdalom teljesen enyhülhet, míg a PRP okozta fájdalomcsillapítás a vérlemezkekoncentráció felével jelentősen csökken.Ezért több klinikai vizsgálatot bátorítunk a különböző PRP-készítmények fájdalomcsillapító hatásának vizsgálatára.
PRP és angiogenezis hatás
A C-PRP készítmények a precíz regeneratív gyógyászatban lehetővé teszik a célszöveti helyeken aktivált, nagy koncentrációjú vérlemezkék által felszabaduló biomolekulák szállítását.Ezért számos kaszkádreakció indult be, amelyek hozzájárulnak a helyszíni immunszabályozáshoz, a gyulladásos folyamatokhoz és az angiogenezishez, hogy elősegítsék a gyógyulást és a szövetek helyreállítását.
Az angiogenezis egy dinamikus, többlépéses folyamat, amely magában foglalja a csírázást és a szöveti mikroereket a már meglévő erekből.Az angiogenezis számos biológiai mechanizmusnak köszönhető, beleértve az endothelsejtek migrációját, proliferációját, differenciálódását és osztódását.Ezek a sejtfolyamatok előfeltételei az új erek kialakulásának.Nélkülözhetetlenek a már meglévő erek növekedéséhez, hogy helyreállítsák a véráramlást és támogassák a szövetjavítás és a szövetregeneráció magas metabolikus aktivitását.Ezek az új erek lehetővé teszik az oxigén és a tápanyagok szállítását, valamint a melléktermékek eltávolítását a kezelt szövetekből.
Az angiogenezis aktivitását a VEGF angiogén faktor és az antiangiogén faktorok (pl. angiosztatin és trombospondin-1 [TSP-1]) stimulálása szabályozza.A beteg és leromlott mikrokörnyezetben (beleértve az alacsony oxigénfeszültséget, az alacsony pH-t és a magas tejsavszintet) a helyi angiogén faktorok helyreállítják az angiogenezis aktivitását.
Számos vérlemezkében oldódó tápközeg, mint például a bázikus FGF és a TGF-β és a VEGF serkentheti az endothel sejteket új vérerek termelésére.Landsdown és Fortier különböző eredményekről számolt be a PRP összetételével kapcsolatban, beleértve számos angiogén szabályozó intrathrombocyta-forrását.Ezen túlmenően arra a következtetésre jutottak, hogy az angiogenezis fokozódása hozzájárul az MSK-betegség gyógyulásához a gyenge vaszkularizációjú területeken, például meniszkuszszakadás, ínsérülés és más, gyenge vaszkularizációjú területeken.
Elősegíti és anti-angiogén vérlemezke tulajdonságokat
Az elmúlt néhány évtizedben publikált tanulmányok bizonyították, hogy a vérlemezkék kulcsszerepet játszanak a primer hemosztázisban, a vérrögképződésben, a növekedési faktor- és citokinfelszabadulásban, valamint az angiogenezis szabályozásában a szöveti helyreállítási folyamat részeként.Paradox módon a PRP α- A granulátumok pro-angiogén növekedési faktorok, antiangiogén fehérjék és citokinek (például PF4, plazminogén aktivátor inhibitor-1 és TSP-1) arzenálját tartalmazzák, és a szerepet játszó specifikus faktorok felszabadulását célozzák. .Szerep az angiogenezisben.Ezért a PRP szerepe az angiogenezis szabályozásában a specifikus sejtfelszíni receptorok aktiválásával határozható meg, a TGF-β pro-angiogén és anti-angiogén reakciókat indít el.A vérlemezkék azon képességét, hogy gyakorolják az angiogenezis útvonalat, a patológiás angiogenezis és a tumor angiogenezis megerősítették.
Thrombocyta eredetű angiogén növekedési faktor és anti-angiogén növekedési faktor, amely α- és sűrű és tapadó molekulákból származik.A legfontosabb, hogy általánosan elfogadott tény, hogy a vérlemezkék angiogenezisre gyakorolt általános hatása pro-angiogén és stimuláló.A PRP-terápia várhatóan szabályozni fogja az angiogenezis indukcióját, ami hozzájárul számos betegség kezelési hatásához, például a sebgyógyuláshoz és a szövetek helyreállításához.A PRP, pontosabban a nagy koncentrációjú PGF és más thrombocyta citokinek beadása angiogenezist, angiogenezist és arteriogenezist indukálhat, mivel a stroma sejtből származó 1a faktor kötődik az endothel progenitor sejtek CXCR4 receptorához.Bill és mtsai.Feltételezhető, hogy a PRP fokozza az ischaemiás neovaszkularizációt, ami az angiogenezis, az angiogenezis és az arteriogenezis stimulálásának köszönhető.In vitro modelljükben az endothel sejt proliferációt és a kapilláris képződést számos különböző PDG indukálta, amelyek közül a VEGF volt a fő angiogén stimulátor.Az angiogenezis út helyreállításának másik fontos és lényeges tényezője a több PGF közötti szinergia.Richardson és mtsai.Bizonyítottuk, hogy az angiogén faktor thrombocyta eredetű növekedési faktor-bb (PDGF-BB) és a VEGF szinergikus aktivitása az érett érhálózat gyors kialakulásához vezetett az egyéni növekedési faktor aktivitásához képest.E tényezők együttes hatását a közelmúltban megerősítették egy tanulmány, amely az agyi kollaterális keringés fokozását vizsgálta egereken, hosszú távú hipoperfúzióban.
A legfontosabb, hogy egy in vitro vizsgálatban mérték a humán köldökvéna endothel sejtjeinek proliferatív hatását és a különböző vérlemezkekoncentrációkat a PRP előkészítő eszköz és a thrombocyta adagolási stratégia kiválasztására, és az eredmények azt mutatták, hogy az optimális vérlemezke dózis 1,5 × 10 6 thrombocyta/μ 50. Az angiogenezis elősegítése.A túl magas vérlemezke-koncentráció gátolhatja az angiogenezis folyamatát, így a hatás gyenge.
Sejtöregedés, öregedés és PRP
A sejtek öregedését különféle ingerek indukálhatják.Ez egy olyan folyamat, amelyben a sejtek leállítják az osztódást, és egyedi fenotípusos változásokon mennek keresztül, hogy megakadályozzák a sérült sejtek korlátlan növekedését, ami fontos szerepet játszik a rák megelőzésében.A fiziológiás öregedés folyamatában a sejtreplikációs öregedés is elősegíti a sejtek öregedését, és csökken az MSC-k regenerációs képessége.
Az öregedés és a sejtöregedés hatásai
In vivo sok sejttípus öregszik és halmozódik fel különböző szövetekben az öregedés során, amelyek között nagyszámú öregedő sejt található.Úgy tűnik, hogy az öregedő sejtek felhalmozódása fokozódik az életkor előrehaladtával, az immunrendszer károsodásával, a szövetkárosodással vagy a stresszhez kapcsolódó tényezőkkel.A sejtek öregedésének mechanizmusát az életkorral összefüggő betegségek, például az osteoarthritis, a csontritkulás és a csigolyaközi porckorong degeneráció kórokozójaként azonosították.Különféle ingerek súlyosbítják a sejtek öregedését.Válaszul az öregedéssel kapcsolatos szekréciós fenotípus (SASP) magas koncentrációjú fehérjesejteket és citokineket választ ki.Ez a speciális fenotípus az öregedő sejtekhez kapcsolódik, amelyekben nagy mennyiségben választanak ki gyulladásos citokineket (például IL-1, IL-6, IL-8), növekedési faktorokat (például TGF-β、 HGF, VEGF, PDGF), MMP és katepszin.A fiatalokkal összehasonlítva a SAPS bizonyítottan növekszik az életkorral, mert az egyensúlyi folyamat megsemmisül, ami a sejtek öregedését és a regenerációs képesség csökkenését eredményezi.Pontosabban ízületi és vázizombetegségekben.Ebben a tekintetben az immunrendszer öregedését az immunsejtek szekréciós spektrumában bekövetkezett jelentős változásnak tekintik, ami arra utal, hogy a TNF-a, IL-6 és/vagy Il-1b koncentrációja növekszik, ami alacsony fokú krónikus gyulladáshoz vezet.Érdemes megjegyezni, hogy az őssejtek diszfunkciója nem sejtes autonóm mechanizmusokkal is összefügg, mint például az öregedő sejtekkel, különösen a SASP-n keresztüli pro-inflammatorikus és antiregeneratív faktorok termelődésével.
Éppen ellenkezőleg, a SASP serkentheti a sejt plaszticitását és a szomszédos sejtek átprogramozását is.Ezenkívül a SASP meg tudja szervezni a kommunikációt különböző immunmediátorokkal, és aktiválja az immunsejteket, hogy elősegítse az öregedő sejtek kiürülését.Az öregedő sejtek szerepének és működésének megértése hozzájárul az MSK izmok és krónikus sebek gyógyulásához és szöveti átépüléséhez.
Figyelemre méltó, hogy Ritcka et al.Széleskörű vizsgálatot végeztek, feltárták a SASP fő és előnyös szerepét a sejtplaszticitás és a szöveti regeneráció elősegítésében, valamint bemutatták az öregedő sejtek átmeneti kezelésének koncepcióját.Óvatosan említették, hogy az öregedés elsősorban jótékony és regeneráló folyamat.
A sejtek öregedése és a PRP potenciálja
Az őssejtek számának csökkenésével az öregedés befolyásolja az őssejtek teljesítményét.Hasonlóképpen, az emberben az őssejtek jellemzői (mint például a szárazság, a proliferáció és a differenciálódás) szintén csökkennek az életkorral.Wang és Nirmala arról számolt be, hogy az öregedés csökkenti az ínsejtek őssejtek jellemzőit és a növekedési faktor receptorok számát.Egy állatkísérlet kimutatta, hogy a PDGF koncentrációja fiatal lovakban magas.Arra a következtetésre jutottak, hogy a GF-receptorok számának és a GF-számnak a növekedése fiatal egyénekben jobb sejtválaszt eredményezhet a PRP-kezelésre, mint az idősebb egyének fiatal egyénekben.Ezek az eredmények rávilágítanak arra, hogy a PRP-kezelés miért lehet kevésbé hatékony vagy akár hatástalan idős, kevesebb őssejttel rendelkező és „rossz minőségű” betegeknél.Bizonyított, hogy a porc öregedésének folyamata megfordul, és a porcsejtek nyugalmi ideje megnő a PRP injekció után.Jia et al.Egér bőrfibroblasztok in vitro fotoöregedéseinek tanulmányozására használják PRP kezeléssel és anélkül, hogy tisztázzák a PGF ellenhatás mechanizmusát ebben a modellben.A PRP csoport közvetlen hatást mutatott az extracelluláris mátrixra, növelte az I-es típusú kollagénszintet és csökkentette a metalloproteinázok szintézisét, jelezve, hogy a PRP képes ellensúlyozni a sejtek öregedését és degeneratív MSK betegségben is.
Egy másik vizsgálatban PRP-t használtak idős egerekből idős csontvelői őssejtek gyűjtésére.Megállapítást nyert, hogy a PRP számos őssejt-funkciót képes helyreállítani az öregedés következtében, például a sejtproliferációt és a kolóniaképződést, valamint rekonstruálni a sejtek öregedésével kapcsolatos markereket.
Nemrég Oberlohr és munkatársai alaposan tanulmányozták a sejtek öregedésének szerepét az izomregeneráció gyengítésében, és a PRP-t és a vérlemezkeszegény plazmát (PPP) értékelték a vázizom-javítás biológiai kezelési lehetőségeiként.Úgy képzelték el, hogy a vázizom-javító PRP- vagy PPP-kezelés a SASP-specifikus sejtmarkerekre szabott biológiai tényezőkön és más olyan tényezőkön alapulna, amelyek fibrózis kialakulásához vezetnek.
Joggal feltételezhető, hogy a PRP alkalmazása előtt a célzott sejtöregedés a lokális SASP faktorok csökkentésével javíthatja a biológiai kezelés hatékonyságának regenerációs jellemzőit.Felmerült, hogy egy másik lehetőség a vázizom-regenerációra irányuló PRP- és PPP-kezelés eredményeinek javítására az öregedő sejtek szelektív eltávolítása öregedő scavengerekkel.Kétségtelen, hogy a PRP sejtek öregedésére és öregedésére gyakorolt hatásával kapcsolatos legújabb kutatási eredmények lenyűgözőek, de még mindig a kezdeti szakaszban vannak.Ezért jelenleg indokolatlan bármilyen javaslatot tenni.
(A cikk tartalmát újranyomtatjuk, és nem vállalunk semmilyen kifejezett vagy hallgatólagos garanciát a cikkben szereplő tartalom pontosságáért, megbízhatóságáért vagy teljességéért, és nem vállalunk felelősséget a cikkben foglalt véleményért, kérjük, értse meg.)
Feladás időpontja: 2023-01-01