A vérlemezkék szerepe a csontvelő aspirációs koncentrátumban
A PRP-t és a csontvelő-aspirációs koncentrátumot (BMAC) számos klinikai kezelésre használják irodai környezetben és sebészetben, mivel regeneratív előnyeiket MSK és gerincbetegségek esetén, krónikus fájdalomcsillapítást és lágyszöveti indikációkat okozzák.A PRP nemcsak a sejtmigrációt és sejtproliferációt szabályozza, hanem hozzájárul az angiogenezishez és az ECM-remodellinghez is, hogy kedvező mikrokörnyezetet hozzon létre, valamint elősegítse a szövetek helyreállítását és regenerálódását.
BMAC javítási folyamat
A BMAC-k heterogén sejtkompozíciók, amelyek BMMSC-ket tartalmaznak, így endogén sejtforrások a regeneratív gyógyászati javító terápia számára.Szerepet játszanak a sejt apoptózis, fibrózis és gyulladás csökkentésében;És aktiválja a sejtproliferációhoz vezető kaszkád reakciót.Ezenkívül a BMMSC-k képesek különféle sejtvonalakká differenciálódni, beleértve az oszteoblasztokat, zsírsejteket, mioblasztokat, hámsejteket és neuronokat.Ezenkívül elősegítik az angiogenezist a parakrin és autokrin útvonalakon keresztül.Szintén fontos, hogy a BMMSC az immunrendszer szabályozásában részt vesz az immunspecifikus sejtektől, amelyek részt vesznek a sebgyógyulás gyulladásos szakaszában.Ezenkívül a BMMSC-k támogatják a sejtek új angiogenezis kezelési helyekre történő toborzását, hogy felgyorsítsák a helyi véráramlás rekonstrukcióját.Jin et al.Bebizonyosodott, hogy elegendő állvány hiányában a BMMSC túlélési aránya, valamint gyógyulást elősegítő javító- és differenciálódási képessége károsodott.Bár a PRP és a BMAC szövetgyűjtése, minta-előkészítése és hatásmechanizmusa eltérő, a vizsgálatok azt mutatják, hogy kiegészíthetik egymást.Valójában a PRP és a BMAC biológiai termékké való kombinálása további előnyökkel járhat.
A PRP és a BMAC kombinálása
Néhány kevéssé ismert kutatás szerint a PRP és a BMAC kombinálásának alapelve több premisszon alapul.Először is, a PRP megfelelő mikrokörnyezetet biztosíthat, amelyben a BMSC fokozhatja a sejtek proliferációját és differenciálódását, valamint fokozhatja az angiogenezist.Másodszor, a PRP-t használták ezekhez a sejtekhez a BMAC-vel együtt.Éppen ellenkezőleg, a PRP és a BMAC kombinációja hatékony biológiai eszközzé válhat a BMMSC populáció vonzására.A PRP-BMAC vegyületet tendinosis, sebek, gerincvelő-sérülések, degeneratív csigolyaközi lemezek és osteochondralis defektusok kezelésére alkalmazták, nagy regenerációs potenciállal.Sajnos, bár a heterogén csontvelősejt-komponensek közé tartoznak a vérlemezkék, kevés jelentés említi a vérlemezkék koncentrációját az extrahált csontvelőben és a BMAC kezelés után, de megfelelő aspirációs módszerekkel kivonhatók.További kutatásokra van szükség annak megértéséhez, hogy szükség van-e további vérlemezke-koncentrátumok alkalmazására a BMAC-val együtt.Jelenleg nem állnak rendelkezésre adatok a vérlemezkék és az MSC (vagy más csontvelősejtek) sejtekhez viszonyított optimális arányáról, ami pozitív hatással lenne az MSC táplálkozási mechanizmusára a szövetek helyreállításában.Ideális esetben a csontvelő-gyűjtő berendezés és technológia optimalizálható elegendő csontvelő-thrombocyta kinyerésére.
PRP növekedési faktor és BMAC táplálkozási hatás
A PRP thrombocyta növekedési faktor kulcsfontosságú fehérje, amely részt vesz a BMAC helyreállítási folyamatában.A PGF és más, a BMAC táplálkozási folyamatában részt vevő citokinek sokfélesége beindíthatja a szövetek helyreállítását azáltal, hogy csökkenti a sejt apoptózisát, az anabolizmust és a gyulladáscsökkentő hatásokat, valamint aktiválja a sejtproliferációt, differenciálódást és angiogenezist parakrin és autokrin útvonalakon keresztül.
A vérlemezkékből származó növekedési faktor és a sűrű granulátum komponensek nyilvánvalóan részt vesznek a BMAC táplálkozási folyamatában, és támogatják az MSC által kiváltott szövetek helyreállítását és regenerációját.Rövidítések: MSC: mezenchimális őssejtek, HSC: hematopoietikus őssejtek.
Nyilvánvaló, hogy az OA kezelésében a PDGF specifikus szerepet játszik a porc regenerációjában és a homeosztázis fenntartásában az MSC proliferáción, valamint az IL-1 által kiváltott kondrocita apoptózis és gyulladás gátlásán keresztül.Ezen kívül három TGF-β Az altípusok aktívak a porcképződés serkentésében és a gyulladás gátlásában, és intermolekuláris kölcsönhatáson keresztül képesek elősegíteni az MSC-vel kapcsolatos szövetek gyógyulását.Az MSC táplálkozási hatása összefügg a PGF aktivitásával és a javító citokinek szekréciójával.Ideális esetben ezeknek a citokineknek jelen kell lenniük a BMAC kezelőpalackban, és a szövetsérülés helyére kell szállítani, hogy elősegítsék az MSC-vel kapcsolatos legjobb terápiás szövetgyógyulást.
Egy közös OA vizsgálatban Mui ñ os-L ó pez et al.Azt mutatja, hogy az ízületi szövetből származó MSC funkciója megváltozott, aminek következtében a helyreállítási képessége elveszett.Érdekes módon a PRP közvetlen injekciója az osteoarthritis subchondralis csontjába az MSC csökkenését eredményezte az ízületi folyadékban, ami klinikai javulást jelez.A terápiás hatást az OA-s betegek ízületi folyadékában a gyulladásos folyamat csökkentése közvetíti.
Kevés információ áll rendelkezésre a PGF jelenlétéről vagy koncentrációjáról a BMAC-ban, illetve a BMMSC táplálkozási funkciójának támogatásához szükséges ideális arányról.Egyes klinikusok a magas PRP-koncentrációt BMAC-val kombinálják, hogy több biológiailag aktív graftot kapjanak, ami várhatóan optimalizálja a regeneratív gyógyászat kezelési eredményeit.Azonban kevés biztonságossági és hatékonysági adat áll rendelkezésre, ami azt jelzi, hogy a magas PRP-koncentráció és a BMAC kombinálása hatékonyabb kezelési lehetőség.Ezért úgy gondoljuk, hogy nem lehet helyénvaló a BMMSC-t úgy manipulálni, hogy ebben a szakaszban magas vérlemezke-koncentrációval aktiválják őket.
A vérlemezkék kölcsönhatása vérlemezke-gátló gyógyszerekkel és NSAID-okkal
A PRP szekréciós komponensek széles spektrumát tartalmazza, és számos biológiai közegből áll.A PRP terápiás hatása ezeknek a mediátoroknak tulajdonítható.Bár a vérlemezkékben lévő terápiás mediátorok jól ismertek, ezen anabolikus és katabolikus gyógyszerek optimális összetétele és kinetikája nem teljesen világos.A terápiás készítmények elérésének egyik fő korlátja ezen biológiai mediátorok változékonyságának leküzdése annak érdekében, hogy megcélozzuk a jól szabályozott downstream hatásokat, amelyek mindig megismételhetők és klinikailag előnyösek.Emiatt a gyógyszerek (például a nem szteroid gyulladáscsökkentők (NSAID)) befolyásolhatják a vérlemezke-szekréciós csoportok felszabadulását.Egy nemrégiben végzett nyílt elrendezésű, rögzített szekvenciájú vizsgálatban 81 mg aszpirin (ASA) napi bevitele csökkentette a kulcsfontosságú mediátorok, például a TGF-β 1, a PDGF és a VEGF expresszióját.
Ezek a hatások a ciklooxigenáz-1 (COX-1) irreverzibilis gátlásának és a ciklooxigenáz-2 (COX-2) szabályozható gátlásának tulajdoníthatók, amelyek a thrombocyta-degranulációhoz szükséges két enzim.Egy közelmúltbeli szisztematikus áttekintés megállapította, hogy a thrombocyta-aggregációt gátló gyógyszerek COX-1 és COX-2 függő módon csökkenthetik a növekedési faktor felszabadulási görbét, és a 15 vizsgálatból 8 azt találta, hogy a növekedési faktorok csökkentek.
A gyógyszereket (pl. NSAID-okat) általában az MSK-betegség okozta fájdalom enyhítésére és gyulladás csökkentésére használják.Az NSAID-ok mechanizmusa a thrombocyta-aktiváció gátlása azáltal, hogy irreverzibilisen kötődnek a COX enzimhez, és szabályozzák az arachidonsav útvonalat.Ezért a vérlemezkék funkciója a vérlemezkék teljes életciklusa alatt megváltozik, megakadályozva ezzel a PGF jelátvitelt.Az NSAID-ok gátolják a citokintermelést (pl. PDGF, FGF, VEGF és IL-1 β, IL-6 és IL-8), miközben fokozzák a TNF-α-t. Azonban kevés adat áll rendelkezésre az NSAID-k PRP-re gyakorolt molekuláris hatásáról.Nincs konszenzus a PRP elkészítésének és beadásának legjobb időpontjáról az NSAID-okat használó betegeknél.Mannava és munkatársai számszerűsítették az anabolikus és katabolikus biológiai tényezőket a naproxent szedő egészséges önkéntesek leukocitában gazdag PRP-jében.Azt találták, hogy a naproxen egy hetes alkalmazása után a PDGF-AA és a PDGF-AB (az angiogenezist elősegítő hatékony mitogén) szintje jelentősen csökkent.Egy hét elteltével a növekedési faktor szintje visszatért az alapszint közelébe.A naproxen egyhetes alkalmazása után a proinflammatorikus és katabolikus IL-6 faktor LR-PRP szintje is csökkent, és egyhetes kiürülési periódus után visszatért a kiindulási szintre.Jelenleg nincs olyan klinikai vizsgálat, amely bizonyítaná, hogy a PRP-kezelés után naproxennel kezelt betegek negatív eredményeket mutatnak;Javasoljuk azonban, hogy fontolja meg az egyhetes mosási időszakot, hogy a PDGF-AA, PDGF-BB és IL-6 értékeket visszaállítsák az alapszintre, hogy javítsák biológiai aktivitásukat.További kutatásokra van szükség ahhoz, hogy teljes mértékben megértsük a thrombocyta-aggregáció-gátló és az NSAID hatását a PRP szekréciós csoportra és annak downstream célpontjaira.
A vérlemezkében gazdag plazma alkalmazását kombinálja a rehabilitációval
Bár az alapvető tudományos kutatások azt mutatják, hogy a fizikoterápiának és a mechanikai terhelésnek egyértelmű szerepe van a PRP injekció utáni inak szerkezetének helyreállításában, nincs konszenzus a PRP kezelés utáni MSK betegség legjobb rehabilitációs tervében.
A PRP kezelés magában foglalja a koncentrált vérlemezkék befecskendezését a helyi szöveti környezetbe a fájdalom szabályozása és a szövetek helyreállításának elősegítése érdekében.A legerősebb klinikai bizonyíték a térd OA-ra vonatkozik.Azonban a PRP alkalmazása a tünetekkel járó tendinosis kezelésében ellentmondásos, és a közölt eredmények eltérőek.Az állatkísérletek általában a tendinosis szövettani javulását mutatják a PRP infiltráció után.Ezek a vizsgálatok azt mutatják, hogy a mechanikai terhelés képes regenerálni az inakat, és a terhelés és a PRP injekció együttesen elősegíti az inak gyógyulását.A PRP-készítményekben, a biológiai készítményekben, a készítményekben, az injekciós sémákban és az ínsérülések altípusaiban mutatkozó különbségek eltéréseket eredményezhetnek a klinikai eredményekben.Ezen túlmenően, bár a tudományos bizonyítékok alátámasztják a rehabilitációs tervek előnyeit, kevés publikált klinikai vizsgálat próbálja kezelni és integrálni a következetes PRP utáni rehabilitációs terveket.
Nemrég Onishi et al.Áttekintették a mechanikai terhelés és a PRP biológiai hatásának szerepét Achilles-ín betegségben.Kiértékelték a PRP-vel kezelt Achilles-ín betegség I. és II. fázisú klinikai vizsgálatait, a PRP injekció utáni rehabilitációs tervre összpontosítva.Úgy tűnik, hogy a felügyelt rehabilitációs programok javítják a gyakorlati megfelelést, valamint javítják az eredményeket és a gyakorlati dózis monitorozásának képességét.Számos jól megtervezett Achilles-ín PRP vizsgálat kombinálta a PRP utáni kezelést a mechanikai terheléses rehabilitációs tervvel a regenerációs stratégia szerves részeként.
Jövőbeli kilátások és következtetések
A PRP berendezések és előkészítési módszerek technikai fejlődése ígéretes betegeredményeket mutat, bár a különböző PRP biológiai ágensek meghatározása és a végtermék releváns biológiai jellemzői még mindig nem egyértelműek.Ezenkívül a PRP indikációkban és alkalmazásokban rejlő lehetőségeket még nem határozták meg.Egészen a közelmúltig a PRP-t a kereskedelemben autológ vérszármazékként értékesítették, amely lehetővé teheti az orvosok számára, hogy autológ vérlemezke növekedési faktor technológiát alkalmazzanak meghatározott patológiákban és betegségekben.Eleinte a PRP sikeres alkalmazásának egyetlen kritériuma, amelyet gyakran emlegetnek, az az előkészített minta, amelynek vérlemezke-koncentrációja magasabb, mint a teljes vérérték.Szerencsére ma már a szakemberek átfogóbb ismeretekkel rendelkeznek a PRP működéséről.
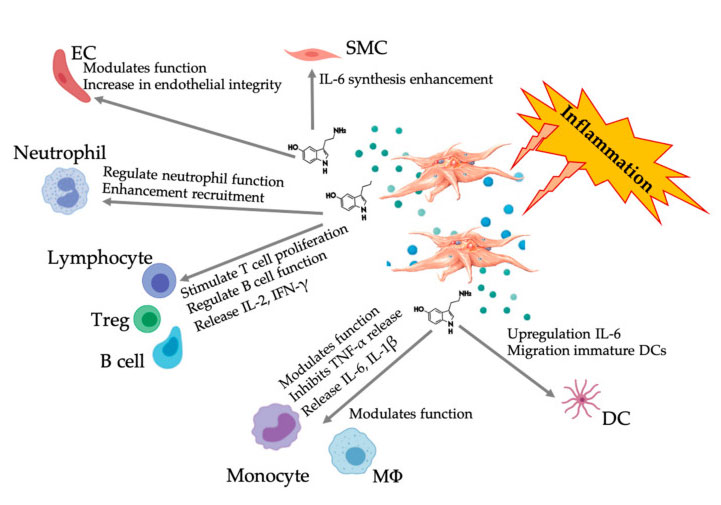
Ebben az áttekintésben elismerjük, hogy még mindig hiányzik a szabványosítás és az osztályozás az előállítási technológia terén;Ezért jelenleg nincs konszenzus a PRP biológiai ágenseivel kapcsolatban, bár több irodalomban egyetértés született az (új) angiogenezis elősegítéséhez szükséges effektív thrombocytadózis-koncentrációról.Itt röviden bemutattuk a PGF-ek aktivitását, de tágabban tükröztük a fehérvérsejtek és MSC-k specifikus thrombocyta mechanizmusát és effektor hatását, valamint az ezt követő sejt-sejt kölcsönhatást.Különösen a fehérvérsejtek PRP-készítményekben való jelenléte teszi lehetővé a káros vagy jótékony hatások mélyebb megértését.Szóba került a vérlemezkék egyértelmű szerepe és a veleszületett és adaptív immunrendszerrel való kölcsönhatásuk.Ezenkívül elegendő és jól dokumentált klinikai vizsgálatok szükségesek a PRP teljes potenciáljának és terápiás hatásának meghatározásához különböző indikációkban.
(A cikk tartalmát újranyomtatjuk, és nem vállalunk semmilyen kifejezett vagy hallgatólagos garanciát a cikkben szereplő tartalom pontosságáért, megbízhatóságáért vagy teljességéért, és nem vállalunk felelősséget a cikkben foglalt véleményért, kérjük, értse meg.)
Feladás időpontja: 2023-01-01